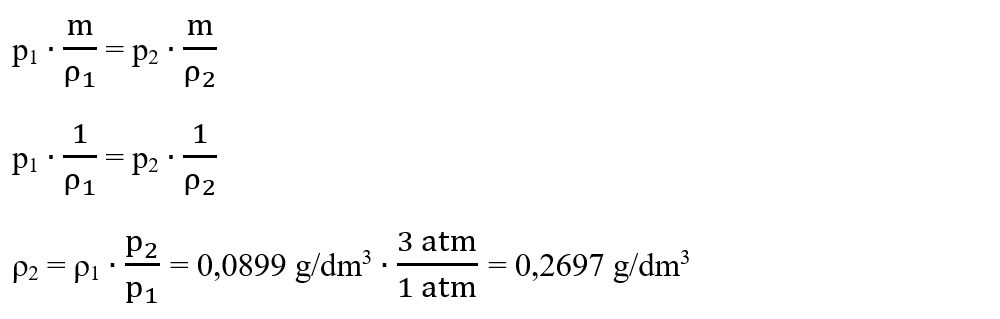VI.4. Masa moleculară relativă a unui gaz. Densitatea relativă a gazelor.
Densitatea (ρ) este egală cu raportul dintre masa gazului (m) și volumul masei respective de gaz (V).

Pornind de la ecuația de stare și de la definiția molului, se obține relația:

Masa moleculară relativă (M) a unui gaz:

unde:
R = constanta universală a gazelor = 8,21∙ 10-2 L ∙ atm /mol ∙ K
p = presiunea gazului ideal
T = temperatura gazului ideal
ρ = densitatea gazului
Deci, putem afla masa moleculară relativă (M) a unui gaz prin determinarea experimentală a temperaturii, presiunii și densității gazului, în condițiile date.
În condiții normale, adică la T = 273 K și p = 1 atm, obținem pentru masa moleculară relativă (M) a unui gaz relația:
M = Vμ ∙ ρ
Densitatea relativă (d) este o mărime fără dimensiuni și definește densitatea unei substanțe în raport cu densitatea altei substanțe.
În cazul gazelor, densitatea relativă se exprimă, cel mai frecvent, în raport cu densitatea aerului

Pentru 1 mol de gaz avem:

Masa moleculară relativă (M) a unui gaz este:
M = Maer ∙ d
unde:
Maer = 28,9 – este masa moleculară relativă a aerului
d - densitatea relativă a gazului
🔦 Observații
1) Folosirea densității relative în calculul masei moleculare a gazelor are avantajul că valoarea densității relative nu se schimbă cu temperatura sau cu presiunea.
2) Când avem un amestec de două substanțe diferite, o serie de mărimi fizice sunt aditive (se pot însuma):
- Numărul de particule N = N1 + N2
- Masele substanțelor: m = m1 + m2
- Numărul de moli: ν = ν1 + ν2
- Volumele: V = V1 + V2
În schimb, alte mărimi nu sunt aditive:
- Masele molare : μ ≠ μ1 + μ2
- Temperaturile: T ≠ T1 + T2
- Presiunile: p ≠ p1 + p2
🔓 Probleme rezolvate
1. Un oxid al sulfului are densitatea față de aer 2,768. Determină formula moleculară a compusului.
Rezolvare:
Se determină masa moleculară relativă (M) a compusului din următoarea relație:
M = Maer ∙ d
Maer = 28,9 – este masa moleculară relativă a aerului
d - densitatea relativă a gazului
M = Maer ∙ d = 28,9 ∙ 2,768 = 79,99 ≈ 80
Considerăm că substanța conține 1 atom de sulf și atunci avem:
80 g – 32 g = 48 g
48 : 16 = 3 atomi de oxigen
Formula moleculară a compusului este SO3.
2. Densitatea hidrogenului la 0 °C și 1 atm este 0,0899 g/dm3. Ce densitatea are hidrogenul la 0 °C și 3 atm ?
Rezolvare:
Scriem datele problemei:
t1 = t2 = 0 °C
p1 = 1 atm
ρ2 = 3 atm
ρ1 = 0,0899 g/dm3
ρ2 = ?
Aplicăm legea lui Boyle-Mariotte întrucât T = const. și ν = const.:
p ∙ V = const.
p1 ∙ V1 = p2 ∙ V2
Înlocuim volumul din formula densității V = m/ρ