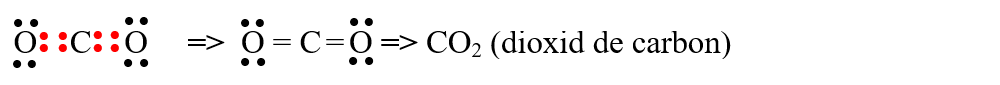IV.2.3. Legătura covalentă polară.
Legătura covalentă polară se formează prin punerea în comun de electroni între atomi diferiți. Se formează substanțe compuse moleculare (compuși moleculari).
La formarea legăturii covalente polare, atomul cu caracter nemetalic mai pronunțat atrage mai puternic electronii puși în comun, astfel încât densitatea norului electronic este mai mare în apropierea acestuia și molecula se alungește.
Molecula polară are doi poli (δ+ și δ-), numită dipol. Întrucât electronii puși în comun nu sunt complet deplasați la atomul cu caracter mai puternic electronegativ (cum avem la ioni), sarcinile care apar în dipoli nu au valoare întreagă, ci una fracționară. Din acest motiv notăm dipolii cu litera mică grecească delta, δ+ și δ- și spunem că legătura covalentă polară are un caracter parțial ionic.
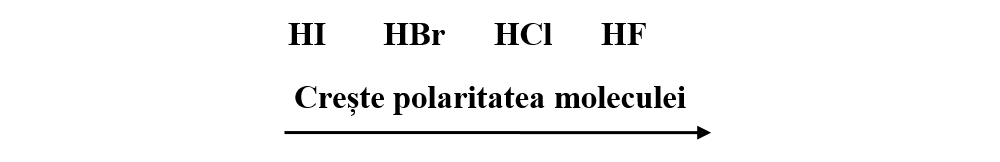
Cu cât diferența dintre caracterul electronegativ al elementelor componente este mai mare, cu atât și polaritatea legăturii covalente este mai pronunțată.
Exemple:
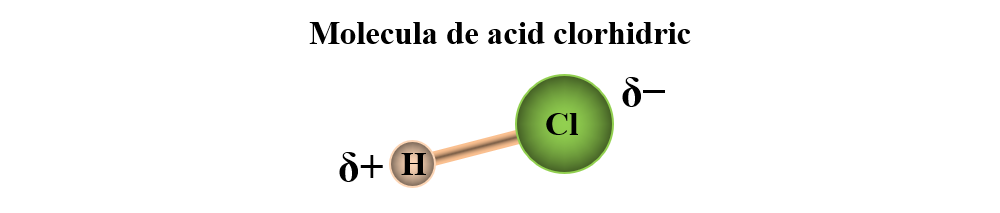
a) formarea moleculei de acid clorhidric (HCl) prin punerea în comun a electronului atomului de H cu un electron de la un atom de Cl. Dubletul electronic de legătură este mai puternic atras de atomul de Cl cu un caracter nemetalic mai puternic:
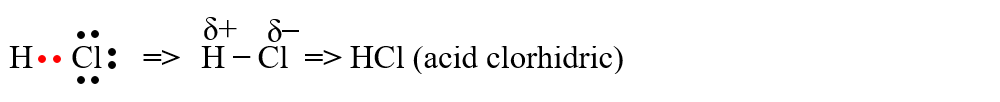
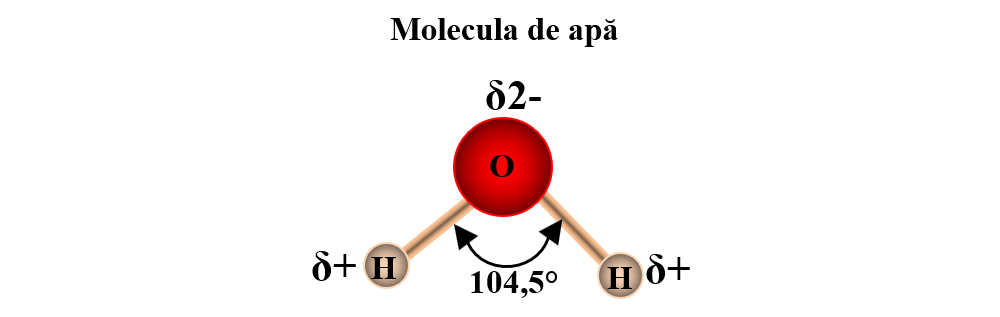
b) formarea moleculei de apă (H2O): prin punerea în comun a celor 2 electroni necuplați ai O cu electronii de la 2 atomi de H. Molecula de apă are o polaritate accentuată datorită caracterului nemetalic pronunțat al atomului de O. Datorită polarității moleculei, apa este un bun solvent pentru substanțele ionice și compușilor polari. În schimb, apa nu poate dizolva compuși nepolari.

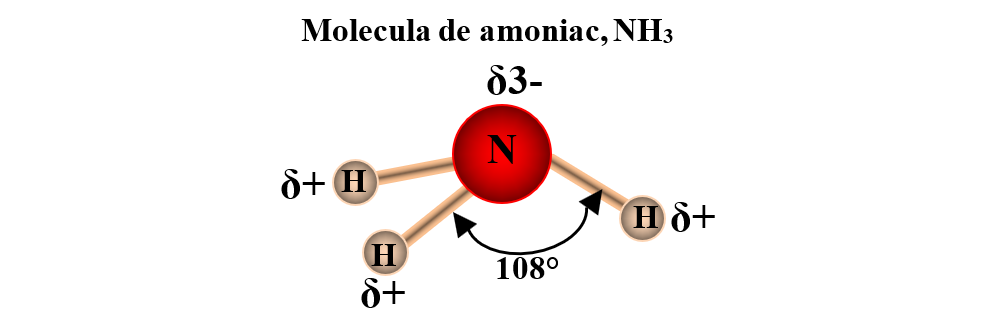
c) formarea moleculei de amoniac (NH3): atomul de azot are 3 electroni necuplați (1s22s22p3) și pune în comun electroni cu 3 atomi de H.
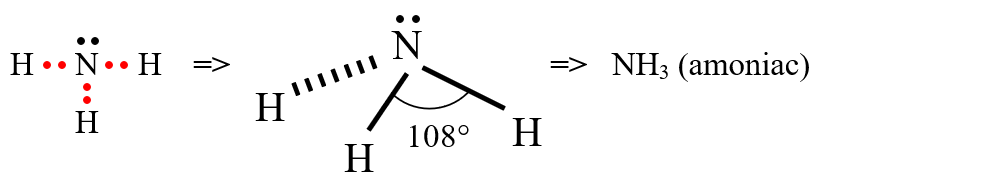
🔦 Observație importantă
Există molecule care, deși sunt formate din atomi diferiți, sunt molecule nepolare datorită simetriei geometrice.
Example:
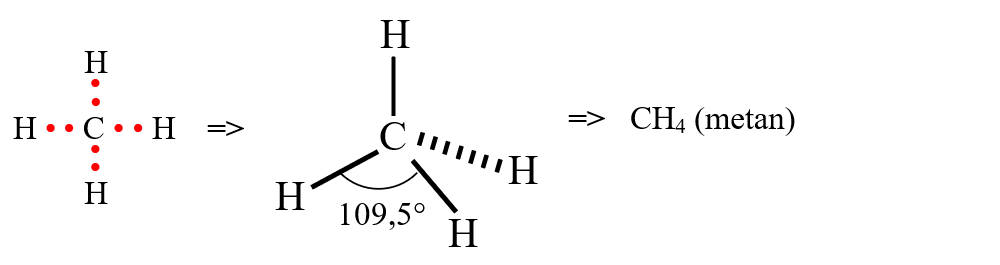
- molecula de metan (CH4) are patru legături covalente sigma simetrice, având un caracter nepolar deoarece dipolii legăturii se anulează unul pe altul:
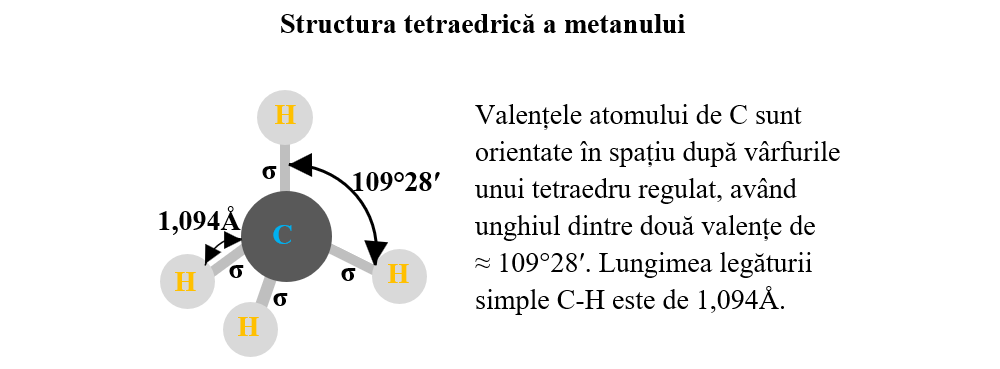
- molecula de tetraclorură de carbon (CCl4) are patru legături covalente sigma simetrice, având un caracter nepolar deoarece dipolii legăturii se anulează unul pe altul:
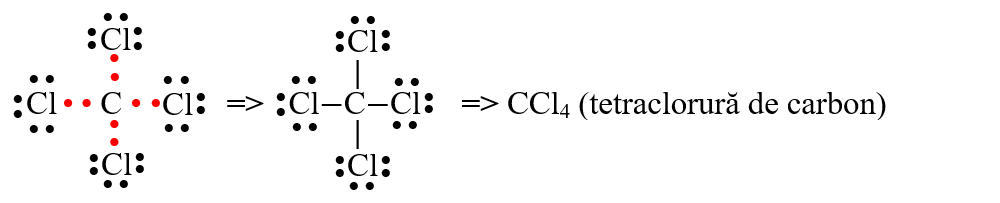
- molecula de dioxid de carbon (CO2) are două legături covalente duble simetrice, având un caracter nepolar deoarece dipolii legăturii se anulează unul pe altul: