III.7.4. Calcule stoechiometrice cu puritate
1. 30 g var de puritate 90% reacționează cu apa formând apa de var / var stins (hidroxid de calciu). Ce masă de Ca(OH)2 se formează?
Rezolvare:
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
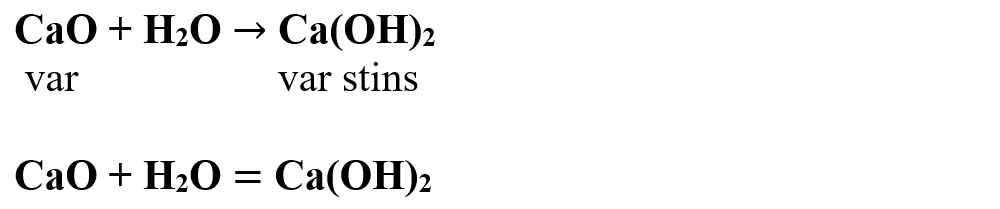
Aceasta se citește astfel:
1 mol de oxid de calciu reacționează cu 1 mol de apă și rezultă 1 mol de hidroxid de calciu.
Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe:
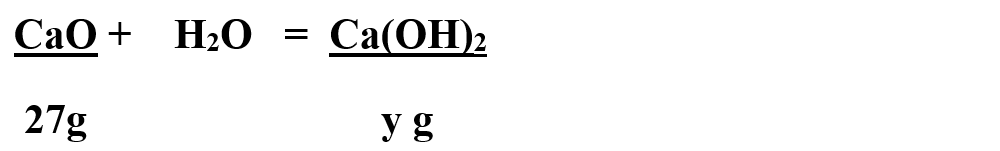
Calculăm masa molară a CaO și Ca(OH)2:
μ CaO = 1 ∙ ACa + 1 ∙ AO = 1 ∙ 40 + 1 ∙ 16 = 56 g/mol
μ Ca(OH)2 = 1 ∙ ACa + 2 ∙ AO + 2 ∙ AH = 1 ∙ 40 + 2 ∙ 16 + 2 ∙ 1 = 74 g/mol
Calculăm masa pură = mp de CaO:

Calculăm masa de Ca(OH)2 obținut:

2. 54 g aluminiu pur reacționează cu oxigenul rezultând 51 g oxid de aluminiu. Cât este puritatea aluminiului introdus în reacție?
Rezolvare:
Scriem datele problemei:
mi = 54 g Al impur
m = 51 g Al2O3
P = ?
Scriem reacția chimică și apoi o egalăm (scriem ecuația chimică):
4 Al + 3 O2 = 2 Al2O3
Aceasta se citește astfel:
4 moli de aluminiu reacționează cu 3 moli de oxigen și rezultă 2 moli de oxid de aluminiu.
Citim datele problemei și subliniem substanțele care se dau și cele care se cer și le trecem sub substanțe:

Calculăm masa molară a Al2O3:
μ Al2O3 = 2 ∙ AAl + 3 ∙ AO = 2 ∙ 27 + 3 ∙ 16 = 102 g/mol
Calculăm masa pură = mp de Al intrată în reacție:
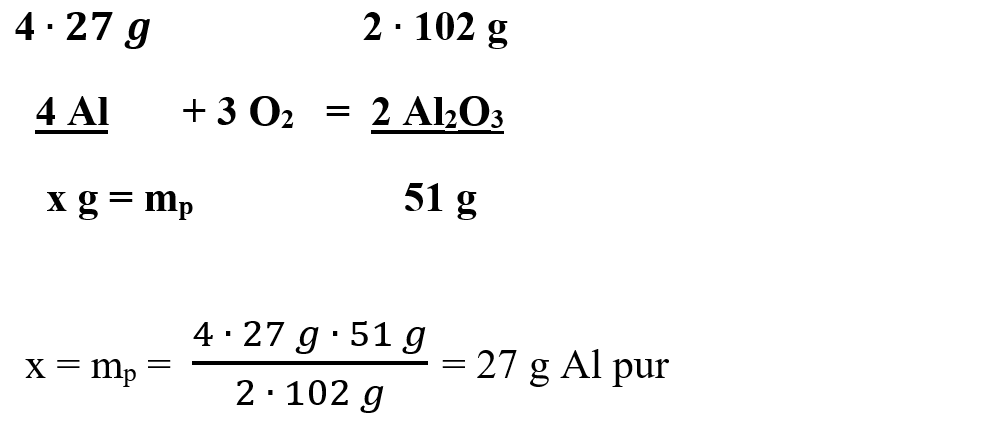
Calculăm puritatea Al cu formula:
