VIII.5.2. Baterii (elemente galvanice) uscate. Pila Leclanché.
Pila Leclanché este cea mai utilizată baterie uscată. Ea a fost inventată în 1867 de către chimistul francez George Leclanché.
Elementul Leclanché este o pilă primară, adică o pilă în care curentul electric se produce prin reacții între reactanții care se găsesc în pilă și care nu se pot regenera.
Bateriile uscate sunt folosite pentru alimentarea cu curent electric a calculatoarelor de buzunar, ceasurilor electronice, radiourilor portabile, jucăriilor etc.
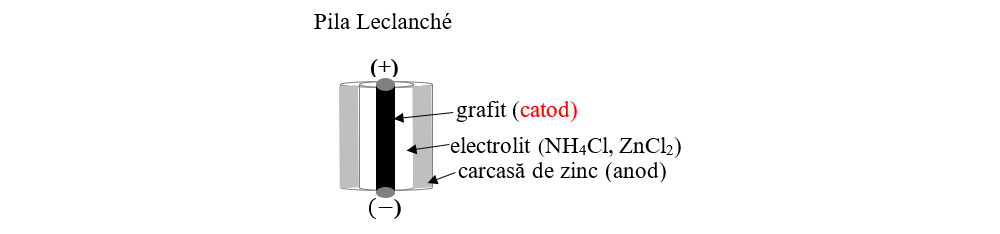
Construcția pilei Leclanché:
- Anodul este format dintr-un cilindru de zinc.
- Electrolitul este o pastă din NH4Cl, ZnCl2 și amidon, care se pune în cilindrul de Zn.
- Catodul este format din grafit înconjurat din MnO2 (depolarizator), fiind așezat în mijlocul cilindrului de Zn.
Reacţiile redox după care funcţionează bateria de buzunar sunt destul de complexe, dar simplificate le putem scrie astfel:
Anod (-):
Zn0 → Zn2+ + 2ē - reacție de oxidare
Electrolitul:
NH4Cl ⇄ NH4+ + Cl-
Catod (+):
2NH4+ (aq) + 2MnO2 (s) + 2ē → Mn2O3 (s) + H2O (l) + 2NH3 (aq) - reacție de reducere
Pila Leclanché (bateria de buzunar) are un preţ de cost redus, o construcție simplă, dar are ca dezavantaj principal faptul că în timpul funcţionării produce apă, care diluează în timp electrolitul și bateria va "curge" dacă nu este perfect etanşă.
Acest dezavantaj a fost remediat prin modificarea electrolitului în bateriile alcaline, care au ca electrolit gel de KOH în care este dispersată pulbere de zinc.
Reacţiile redox după care funcţionează bateria alcalină sunt destul de complexe, dar simplificate le putem scrie astfel:
Anod (-) Zn | KOH || MnO2 | C (+) Catod
Un alt tip de baterie uscată este bateria de argint cu anod de Zn și catod de Ag2O ca agent oxidant în mediu bazic.
O baterie utilizată pentru minicalculatoare, dispozitive auditive și stimulatoare cardiace este bateria cu mercur, care are anodul de Zn și catodul de HgO, ca agent oxidant în mediu bazic.
Bateria reîncărcabilă nichel-cadmiu poate fi reîncărcată de nenumărate ori, fără să se degradeze. Ea are anod de Cd și catod de NiO2, ca agent oxidant în mediu bazic.
Anod (-): Cd + 2HO- → Cd(OH)2 + 2ē - reacție de oxidare
Catod (+) : NiO2 + 2H2O + 2ē → Ni(OH)2 + 2HO- - reacție de reducere