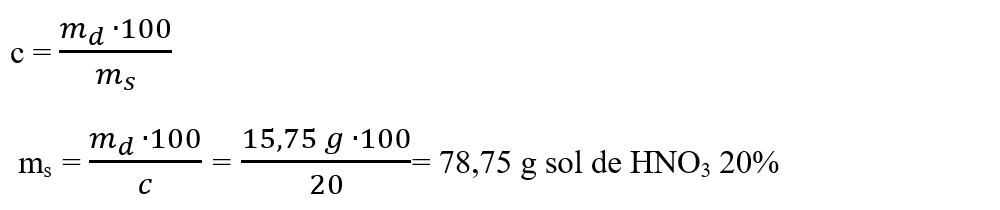V.4.3. Cristalohidrați*.
Numeroase săruri se găsesc în natură sub formă de cristalohidrați.
Cristalohidrații sunt cristale care au înglobată în ele un anumit număr de molecule de apă, numită apă de cristalizare.

Cristalohidrați
Piatră vânătă

Sodă cristalizată

Ghips

Sare amară (sare Epson)

Calaican

Alaun (piatră acră)

Borax

Prin încălzire, cristalohidrații pierd parțial sau total apa de cristalizare. Cei care pierd total apa de cristalizare devin săruri anhidre.
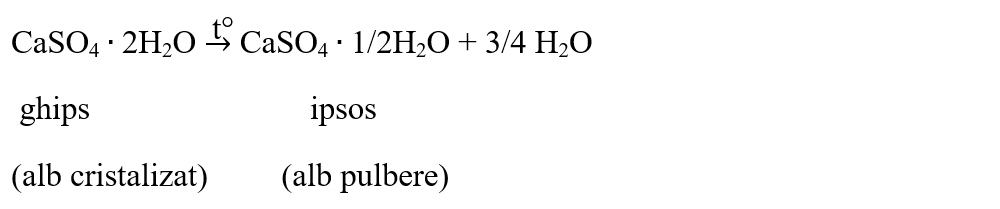

🔦 Observație
Când preparăm soluții cu cristalohidrați trebuie să ținem cont de apa de cristalizare a acestora, deoarece aceasta este o parte din apa necesară preparării soluției.
👀 Experiment: Prepararea unei soluții de cristalohidrat
🔥 Atenție! Acest experiment se realizează numai de către profesor.
🔥 Atenție! Piatra vânătă este toxică și periculoasă pentru mediu!
Materiale necesare:
Pahar Berzelius, piatră vânătă, apă distilată, fiolă, pâlnie de sticlă, balon cotat, spatulă, cântar.
Mod de lucru:
- Se calculează masa de CuSO4 necesară obținerii a 40 g de soluție CuSO4 4% din formula concentrației procentuale de masă :

-
Se calculează masa molară a CuSO4 anhidru:
μ = 1 ∙ ACu + 1 ∙ AS + 4 ∙ AO = 160 g/mol -
Se calculează masa molară a H2O:
μ = 2 ∙ AH + 1 ∙ AO = 18 g/mol -
Se calculează masa molară a cristalohidratului CuSO4 ∙ 5H2O:
μ = 1 ∙ ACu + 1 ∙ AS + 4 ∙ AO + 5 ∙ (2 ∙ AH + 1 ∙ AO ) = 160 + 5 ∙18 = 250 g/mol -
Se observă că din toată masa molară a CuSO4 ∙ 5H2O de 250 g/mol avem 160 g/mol CuSO4 și cu regula de trei simplă aflăm ce masă de CuSO4 ∙ 5H2O conține 1,6 g de CuSO4:

-
Se calculează masa de apă ce trebuie adăugată peste 2,5 g CuSO4 ∙ 5H2O pentru a obține 40 g soluție 4% de CuSO4 :
mapă adăugată = 40 g – 2,5 g = 37,5 g apă -
Se cântăresc 2,5 g de CuSO4 ∙ 5H2O și se introduc cu ajutorul unei pâlnii de sticlă într-un balon cotat de 50 mL.
-
Se cântăresc 37,5 g de apă distilată, se adaugă puțină din această apă în balon și se agită cu grijă amestecul până la dizolvarea completă a dizolvatului.
-
După dizolvare se adaugă restul de apă în balon.
🔓 Probleme rezolvate
1. Calculează numărul de moli de apă corespunzător cristalohidratului MgSO4 ∙ x H2O care conține 51,22% apă.
Rezolvare
Se calculează masa molară a cristalohidratului MgSO4 ∙ x H2O:
μ = 1 ∙ AMg + 1 ∙ AS + 4 ∙ AO + x (2 ∙ AH + 1 ∙ AO ) = 120 + x ∙ 18
Cu regula de trei simplă aflăm valoarea lui x:

Scriem formula cristalohidratului:
MgSO4 ∙ 7 H2O, numit și sare amară.
2. Calculează ce cantitate de soluție de acid azotic 20% reacționează cu 71,5 g de Na2CO3 ∙ 10H2O.
Rezolvare
Se calculează masa molară a Na2CO3 și a cristalohidratului Na2CO3 ∙ 10H2O:
μ Na2CO3 = 106 g/mol
μ Na2CO3 ∙ 10H2O = 106 + 10 ∙18 = 286 g/mol
Cu regula de trei simplă aflăm ce masă de Na2CO3 este conținută de 71,5 g de Na2CO3 ∙ 10H2O :
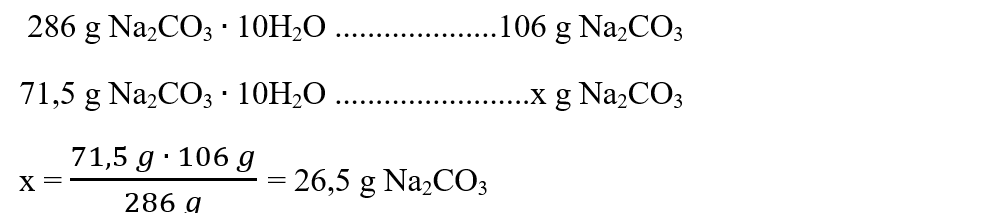
Se calculează masa molară a HNO3:
μ HNO3 = 63 g/mol
Scriem ecuația reacției chimice și aflăm ce masă de acid azotic reacționează cu 26,5 g de Na2CO3 din cristalohidratul dat:

Pentru a afla masa soluției de HNO3 20%, aplicăm formula concentrației procentuale de masă: