II.5. Căldura de formare. Stările standard ale substanțelor.
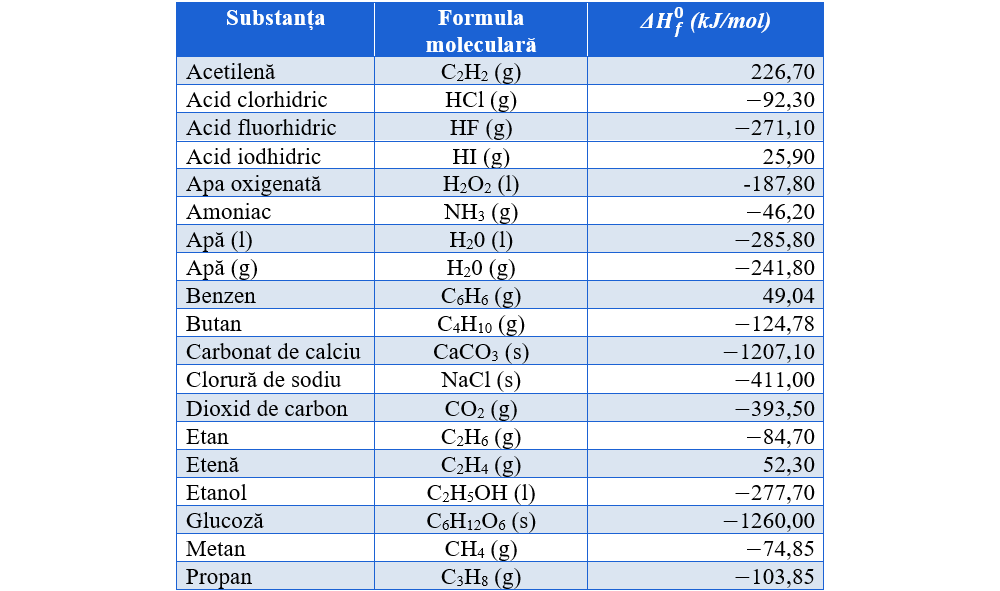
Variațiile de entalpie sunt constante specifice fiecărei transformări fizice/ chimice și care se găsesc în tabele. Există tabele cu entalpii de topire, de vaporizare, de ardere etc.
Chimiștii au stabilit diferite stări standard pentru compararea valorilor variațiilor de entalpie a reacțiilor chimice. Astfel, pentru elemente, stările standard sunt acele forme fizice ale elementului care sunt stabile la presiunea de 1 atm și temperatura de 25 °C.
Variația de entalpie a reacției de sinteză a unui mol de substanță compusă din elementele componente în starea lor standard reprezintă entalpia molară de formare a substanței respective (exprimată în KJ/mol).
Măsurată în condiții standard, entalpia de formare (căldură de formare) se numește entalpie standard de formare și se notează cu ΔHf0.
Sistemele tind să ajungă la o stare minimă de energie și de aceea cu cât entalpia molară de formare (ΔHf0) a unei substanțe este mai mică (negativă), cu atât substanța este mai stabilă.
Stările standard ale substanțelor :
- Prin convenție, entalpia unui element în condiții standard este zero.
- Dacă o substanță există în mai multe stări de agreagare, se alege ca stare standard forma cea mai stabilă.
- În cazul compușilor, starea standard reprezintă starea fizică (solidă/lichidă/gazoasă) a acestora la presiunea de 1 atm și temperatura de 25 °C.
- În cazul soluțiilor, starea standard se consideră soluțiile de concentrație 1M.
Variația de entalpie a reacției este egală cu diferența dintre suma căldurilor de formare standard a produșilor de reacție și suma căldurilor de formare standard a reactanților:
ΔH = Σ νp ∙ Hp – Σ νr ∙ Hr
νp = nr. de moli produși
Hp = entalpiile produșilor de reacție
νr = nr. de moli reactanți
Hr = entalpiile reactanților
🔦 Observație
Entalpia de formare se utilizează pentru determinarea variației de entalpie a reacțiilor sau invers, variația de entalpie a reacțiilor permite calcularea entalpiilor de formare a unor substanțe.
🔓 Probleme rezolvate
1. Cunoscând variația entalpiei a reacției de ardere a aluminiului, determină entalpia molară de formare a oxidului de aluminiu.
Rezolvare:
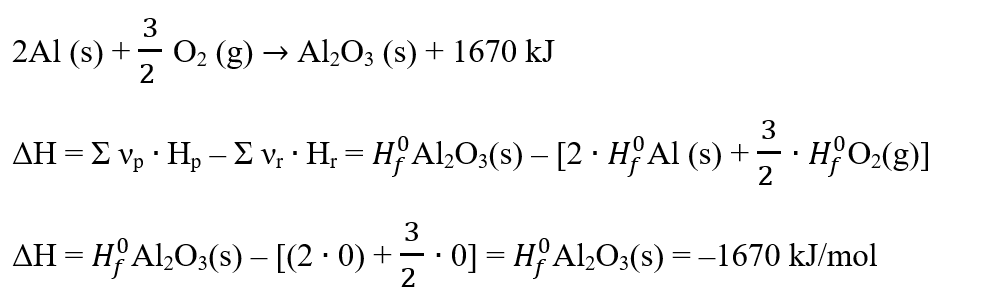
2. Se dau entalpiile molare de formare a dioxidului de carbon și monoxidului de carbon. Află care oxid este mai stabil și variația entalpiei reacției de ardere a monoxidului de carbon.
CO2 (g) : ΔHf0 = –393,5 kJ/mol
CO (g) : ΔHf0 = –110,5 kJ/mol
Rezolvare:
Cu cât entalpia molară de formare (ΔHf0) a unei substanțe este mai mică (negativă), cu atât substanța este mai stabilă. Întrucât CO2 are entalpia de formare mai mică decât CO, putem afirma că CO2 este mai stabil decât CO.
Scriem reacția de ardere a CO:
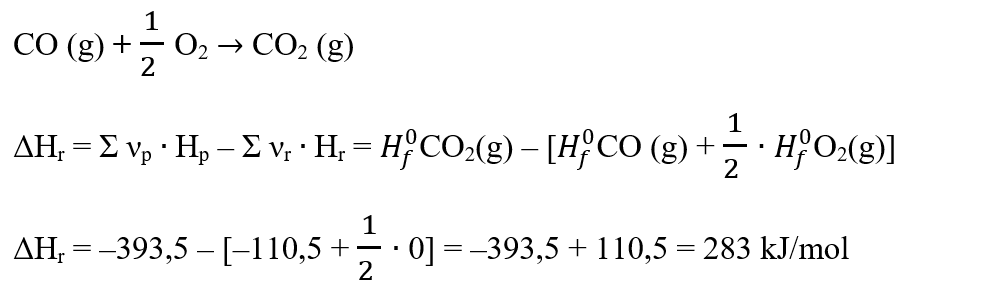
Întrucât variația de entalpie a reacției este pozitivă, înseamnă că sistemul absoarbe energie sub formă de căldură, fiind o reacție endotermă.
🔦 Observație
Atenție! Nu confunda căldura (entalpia) de reacție cu căldura (entalpia) de formare. Astfel, în reacția de formare a apei după ecua�ția:
2H2 (g) + O2 (g) → 2H2O (l); ΔHr = –2 ∙ 285,8 kJ = –571,6 kJ/mol
571,6 kJ reprezintă căldura de reacție sau efectul termic total, în timp ce, pentru formarea unui mol de apă revin 285,8 kJ/mol și care reprezintă căldura de formare a apei lichide.
Tabel cu entalpiile standard de formare pentru diferite substanțe